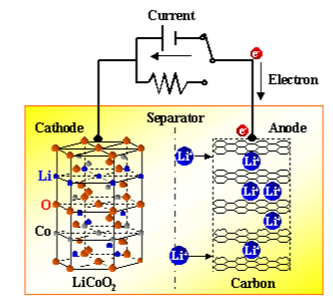
电池负责电解质与金属的氧化和还原反应。当将两种不同的金属物质(称为电极)放入稀释的电解液中时,取决于电极金属的电子亲和力,在电极中分别发生氧化和还原反应。氧化反应的结果是,一个电极带负电,称为阴极,由于还原反应,另一电极带正电,称为阳极。
阴极形成电池的负极端子,而阳极形成电池的正极端子。为了正确理解电池的基本原理,首先,我们应该具有一些电解质和电子亲和力的基本概念。实际上,当将两种不同的金属浸入电解质中时,这些金属之间会产生电势差。
发现,当某些特定的化合物添加到水中时,它们会溶解并产生负离子和正离子。这种化合物称为电解质。电解质的流行示例是几乎所有类型的盐,酸和碱等。中性原子接受电子过程中释放的能量称为电子亲和力。由于不同材料的原子结构不同,因此不同材料的电子亲和力也将不同。
如果将两种不同的金属浸入相同的电解质溶液中,则其中一种将获得电子,而另一种将释放电子。哪种金属(或金属化合物)将获得电子,而哪些将失去电子,取决于这些金属的电子亲和力。具有低电子亲和力的金属将从电解质溶液的负离子中获取电子。
另一方面,具有高电子亲和力的金属将释放电子,这些电子进入电解质溶液并被添加到溶液的正离子中。这样,这些金属中的一种会获得电子,而另一种则会失去电子。结果,这两种金属之间的电子浓度会有所不同。
电子浓度的这种差异导致金属之间产生电势差。该电势差或电动势可以用作任何电子设备或电路中的电压源。这是电池的一般基本原理,这就是电池的工作方式。
所有电池都仅基于此基本原理。让我们一一讨论。正如我们前面所说,亚历山德罗·沃尔塔(Alessandro Volta)开发了第一个电池,这种电池被普遍称为简单伏打电池。这种简单的单元格可以很容易地创建。取一个容器,并用稀硫酸填充作为电解液。现在,我们将一根锌和一根铜棒浸入溶液中,并通过电负载将它们外部连接。现在,您的简单伏打单元已完成。电流将开始流过外部负载。
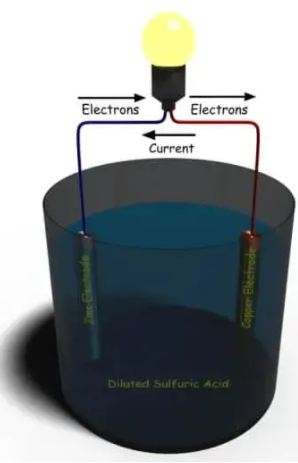
稀硫酸中的锌释放电子如下:
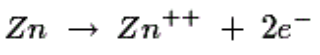
这些Zn +离子进入电解质,并且每个Zn + +离子在棒中留下两个电子。作为上述氧化反应的结果,锌电极被带负电,因此用作阴极。因此,电解质中阴极附近的Zn + +离子的浓度增加。
根据电解质的性质,稀硫酸和水已经分解成正氢键离子和负硫酸根离子,如下所示: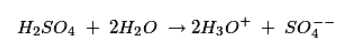
由于阴极附近的Zn + +离子浓度高,H 3 O +离子被排斥了朝向铜电极并通过吸收来自铜棒原子的电子而放电。在阳极上发生以下反应:
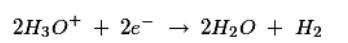
由于在铜电极上发生还原反应,铜棒带正电,因此它充当阳极。